
Khí lí tưởng là khí tuân theo đúng định luật Boyle và định luật Charles.

Quá trình chuyển từ trạng thái (1) qua trạng thái trung gian (1') tới trạng thái (2) của một khối lượng khí xác định
Phương trình trạng thái của một lượng $n$ mol khí lí tưởng, thường được gọi tắt là phương trình trạng thái của khí lí tưởng (phương trình Clapeyron):
\(pV=nRT\) với \(n=\dfrac{m}{M}\)
Trong đó:
- $R$ là hằng số khí lí tưởng ($R$ = 8,31 J/mol.K)
- $n$ là số mol khí
- $m$ là khối lượng khí (kg)
- $M$ là khối lượng mol của lượng khí (kg/mol)
@202694654656@
Phương trình liên hệ giữa áp suất và nhiệt độ tuyệt đối khi thể tích không đổi là:
\(\dfrac{p}{T}=\) hằng số hay \(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\)
Đường biểu diễn sự phụ thuộc của $p$ theo $T$ khi thể tích của khối khí không đổi gọi là đường đẳng tích.
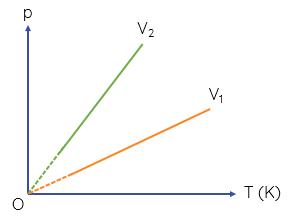
Các đường đẳng tích của một khối khí tương ứng với các thể tích \(V_1\) và \(V_2\) \(\left(V_2< V_1\right)\)
Bạn có thể đăng câu hỏi về bài học này ở đây
Học liệu này đang bị hạn chế, chỉ dành cho tài khoản VIP cá nhân, vui lòng nhấn vào đây để nâng cấp tài khoản.